
Не существует методов лечения и профилактики АЧС, поэтому быстрая диагностика, строгий контроль состояния здоровья животных и противоэпизоотические мероприятия являются основой борьбы против АЧС.
Прогресс в области диагностики, связан с развитием высоко чувствительных методов, позволяющих надежно диагностировать острую, хроническую и инапарантную форму болезни в течение нескольких часов.
Существует множество методов обнаружения вируса и специфических антител. Наиболее часто используемыми в настоящее время методами диагностики АЧС являются: ПЦР (стандартная и в режиме реального времени) для обнаружения вируса; ИФА и имммуноблотинг для исследования сывороток. Дальнейшая схема показывает методы и их применение наиболее часто используемые в референтных лабораториях.
Для подтверждения/исключения АЧС в лабораторию направляют образцы селезенки, почек, лимфатические узлы. Также могут быть направлены образцы крови с антикоагулянтом (ЭДТА) от животных с повышенной температурой. Сыворотку от животных используют в серологических реакциях.
К направляемым образцам должна прилагаться сопроводительная документация с описанием клинического состояния животного.
Сопроводительная документация должна содержать:
На сегодняшний день разработано много методов обнаружения вируса АЧС. Некоторые из них, такие как «сэндвич» ИФА и иммуноблот обычно не используются при контроле и ликвидации болезни, из-за их достаточно высокой чувствительности на ранних стадиях болезни и резким падением чувствительности начиная с 9-10 дня после заражения.
Наиболее часто используемыми методами являются реакция гемадсорбции, реакция прямой иммунофлюоресценции и ПЦР.
Вирус АЧС выделяют с использованием первичной культуры клеток свиных макрофагов. В организме животного вирус инфицирует и реплицируется в лейкоцитах периферической крови, где вызывает развитие цитопатического эффекта в зараженных макрофагах. До наступления лизиса клеток вызванного вируса можно отметить феномен гемадсорбции. Микроскопические наблюдения показывают образование морул и розет из эритроцитов вокруг лейкоцитов.
Некоторые штаммы АЧС являются не гемадсорбирующими. В этих случаях, должны быть проведены дополнительные исследования осадка клеток методами ПЦР и РПИФ, чтобы подтвердить наличие вируса.
Реакция гемадсобции является наиболее специфичным и чувствительным методом идентификации, поскольку ни один из вирусов поражающих свиней не вызывает развитие феномена гемадсорбции. Она является референтной методикой несмотря на трудности в постановке и продолжительности выполнения (5-10 дней). Обычно используется только в референтных лабораториях.
РПИФ рекомендуется использовать при отсутствии возможности проведения ПЦР. Данный метод лучше использовать совместно с другими серологическими тестами (ИФА и иммуноблотинг), что бы исключить ложноотрицательные результаты, вызванные блокировкой антителами.
РПИФ основана на обнаружении вирусных антигенов в срезах тканей или мазках-отпечатках при взаимодействии с флюоресцентным конъюгатом. Это очень быстрый, простой и чувствительный метод, который также может быть использован при исследовании зараженных культур клеток. Микроскопические наблюдения показывают интенсивную флюоресценцию цитоплазматических включений в инфицированных клетках. При активном развитии инфекции флюоресценция может иметь зернистый вид.
В регионах где АЧС является эндемичной, и подострая и хронические формы болезни являются предоминантными, чувствительность данного метода уменьшается и составляет всего 40% при исследовании срезов органов и мазков-отпечатков.
Совместное использование РПИФ и РИФ или ИФА позволяет обнаруживать от 85% до 95% от всех случаев болезни (даже при наличии антител) менее чем за 1 час 15 минут. Не существует коммерческих наборов для данного метода.
ПЦР (полимеразная цепная реакция) наиболее часто используемая техника для обнаружения вируса. Она требует профессиональных навыков и достаточного опыта для постановки реакции, чтобы исключить контаминацию образцов и ложноположительные результаты. ПЦР является очень чувствительной и специфичной техникой обнаружения вируса , путем амплификации вирусной ДНК из исследуемого образца. В настоящее время широко используется референтными лабораториям для диагностики и подтверждения АЧС. ПЦР используется при исследовании образцов тканей и сывороток от животных с клиническими признаками болезни. Вирус припомощи ПЦР удается обнаруживать в крови больных животных начиная со 2 дня после заражения и в течение нескольких недель.
Данный метод основан на применение праймеров комплементарных консервативному участку генома АЧС и позволяет обнаруживать широкий диапозон известных изолятов вируса АЧС, включая как гемадсорбирующие так и не гемадсорбирующие штаммы.
ПЦР может быть использована для исследования образцов плохого качества и малопригодных для исследований другими методами. При помощи ПЦР результаты могут быть получены в течение 5-6 часов.
Существует два различных метода ПЦР-диагностики вируса АЧС. Для обоих из них необходимым является этап пробоподготовки и выделения ДНК перед непосредственным проведением ПЦР (смотри видео):
Стандартная ПЦР (смотри видео) (протокол): продукты реакции, полученные в результате амплификации вирусной ДНК, анализируются при помощи электрофореза в агарозном геле и УФ света.
ПЦР в режиме реального времени (смотри видео) (протокол): Для данного метода необходимо использование специального оборудования для детекции флюоресцентного сигнала. ПЦР в режиме реального времени имеет несколько преимуществ: анализ результатов в ходе реакции (реальном времени), возможность количественного определения вирусной ДНК, не требует постановки электрофореза.
Дальнейшее секвенирование ПЦР продуктов позволяет подтвердить положительные результаты реакции, и также определить генотип вируса при амплификации некотрых фрагментов генома вируса (ген p72, ген p54, центральный вариабельный регион -CVR).
Ввиду отсутствия вакцин против АЧС, наличие специфических антител к вирусу показывает наличие болезни.
Большое количество серологических методов диагностики АЧС было разработано в последние годы, включая методы позволяющие выполнять диагностику в полевых условиях. В настоящее время наиболее используемыми являются реакция непрямой флюоресценции (РИФ), непрямой вариант ИФА и иммуноблотинг (ИБ).
Серологические методы являются основой лабораторной диагностики АЧС и используются в программах контроля и ликвидации болезни, благодаря их высокой чувствительности и специфичности.
Данный метод является достаточно быстрым и обладает хорошей чувствительностью и специфичностью. Специфические к вирусу антитела находящиеся в сыворотке или экссудатах взаимодействуют с клетками инфицированными вирусом АЧС. В настоящее время практически не используется ввиду отсутствия коммерческих наборов для постановки реакции. Время постановки реакции занимает около 2 часов.
В случае положительного образца на клеточном монослое наблюдают флюоресценцию перинуклеарной области клеток, где расположен центр репликации вируса.
Этот метод используется для проведения широкомасштабного эпизоотического мониторинга и исследований при программах контроля болезни. Метод обладает высокой чувствительностью и специфичностью, простотой и быстротой выполнения и экономичностью. Хорошей воспроизводимостью результатов и легкостью интерпретации.
Недавно разработаны новые варианты ИФА, содержащие неинфекционные реагенты на основе рекомбинантных белков вируса p32, p54 и pp62. Они имеют большую чувствительность и специфичность при исследовании сывороток плохого качества.
Разработаны два варианта ИФА для обнаружения специфических к вирусу АЧС антител:
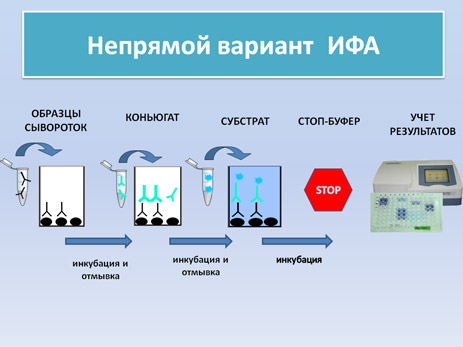
-Hепрямой вариант ИФА-OIE: данный метод разработан в лаборатории CISA-INIA и является официальным методом диагностики одобренным OIE: (смотри видео) (протокол)
Настоящий метод ИФА основан на применение растворимого вирусного антигена содержащего большинство вирусных белков.
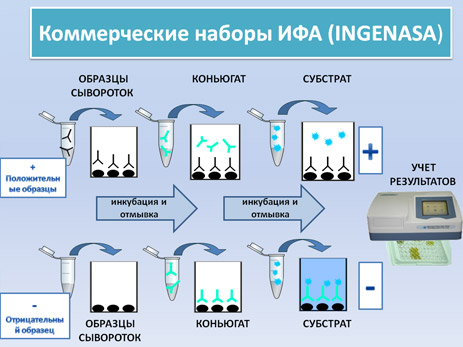
- Коммерческие наборы ИФА (INGENASA): (смотри видео) (протокол)
Это конкурентный вариант ИФА для обнаружения антител к белку vp73 вируса АЧС ( структурного компонента с высокой антигенной силой).
В данном ИФА наборе, на плашках иммобилизован белок vp73. После добавления исследуемой сыворотки, добавляются моноклональные анти-vp73 антитела, меченые пероксидазой. Моноклональные анти-vp73 антитела сорбируются на свободной от специфических антител поверхности плашки. Интерпретация результатов реакция прямо противоположна предыдущему варианту ИФА. Более интенсивная окраска лунки свидетельствует о меньшем количестве антител в сыворотке и наоборот.
Является иммунофрементным методом основанном на применении нитроцеллюлозных фильтров, несущих предварительно сорбированные на них вирусные белки. Специфические к вирусу антитела взаимодействуют с иммобилизованными вирусными белками и получившийся комплекс выявляется при помощи меченого пероксидазой протеина А.
Иммуноблотинг позволяет определить реактивность антител против различных белков индуцируемых вирусом АЧС в сыворотках свиней. Таким образом, наряду с высокой чувствительностью и объективностью получаемых результатов, иммуноблотинг является идеальным методом для подтверждения африканской чумы свиней.
Этот метод выскочувствительный, легко выполним и не требует использования специального оборудования, но также не существует коммерческих наборов. Время постановки реакции занимает около 3 часов.
Другим преимуществом данного метода является возможность хранения стрипов, содержащих антиген, при комнатной температуре, без потери активности в течении более чем одного года, что означает безопасную возможность транспортировки реагентов.