El control genético de la producción de inmunoglobulinas, resuelve con elegancia y creatividad lo que podría ser un grave problema.
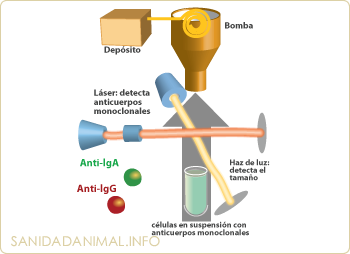
Esquema de funcionamiento del citómetro de flujo para la detección de inmunoglobulinas de superficie en linfocitos B. Las células en suspensión a los que se les han añadido los diferentes AcM (anti IgA e IgG) pasan a través de un tubo muy fino en una sóla fila de células, y son leídas por el láser y el haz de luz; el primero identifica los anticuerpos marcados y el segundo, el tamaño de las células.
INMUNOGLOBULINAS DE SUPERFICIE
Como vimos en el capítulo 2 ¿Cómo se estudian los linfocitos B?, existen varios métodos para estudiar las inmunoglobulinas de membrana de los linfocitos B que forman el receptor BcR. Los dos mas utilizadas son:
- El estudio mediante conjugados monoclonales o policlonales frente a los diferentes isotipos de inmunoglobulinas, marcados con isocianato de fluoresceína y observados al microscopio de fluorescencia.
- El análisis por citometría de flujo, utilizando anticuerpos monoclonales frente a cada isotipo de inmunoglobulina.

Imagen de una aglutinación en tubo
Las inmunoglobulinas libres en suero, calostro, leche, fluidos, etc. pueden ser estudiadas como inmunoglobulinas totales, sin considerar frente a que antígeno reaccionan, o como anticuerpos específicos frente a distintos antígenos de interés. Para este último tipo de estudios, que sin duda es el más interesante, se disponen de un gran número de técnicas que van desde las clásicas de precipitación, fijación de complemento, etc; a las más modernas y cada día mas utilizadas técnicas inmunoenzimaticas.
| Sensibilidad de las diferentes técnicas para la detección de anticuerpos (μg/ml) | |
| MÉTODO | SENSIBILIDAD (μg/ml) |
| Precipitación en gel | 30 |
| Precipitación en anillo | 18 |
| Aglutinación bacteriana | 0,05 |
| Fijación de complemento | 0,05 |
| Hemaglutinación pasiva | 0,01 |
| Inhibición de la hemaglutinación | 0,005 |
| Inmunofluorescencia | 0,005 |
| ELISA | 0,0005 |
| Neutralización bacteriana | 0,00005 |
Las diferencias de sensibilidad, especificidad, capacidad de utilización a gran escala, etc. son algunos de los conceptos más importantes a la hora de seleccionar una u otra técnica. Así, respecto a la sensibilidad podemos observar que hay técnicas con niveles bajos como las de precipitación, de sensibilidad media como las aglutinación bacteriana, fijación de complemento y otras de sensibilidad mayor como el ELISA, la seroneutralización o la actividad bactericida.
El desarrollo de la biología molecular y la producción de anticuerpos monoclonales, ha permitido disponer, en los últimos años, de reactivos de diagnóstico de gran sensibilidad y especificidad, incluso en forma de KITS, de fácil y sencilla realización e interpretación.
De entre todos los métodos actualmente disponibles, destacaremos en este capítulo, por una parte, aquellos que presentan las mayores posibilidades para llevar a cabo estudios serológicos a gran escala y pueden ser realizados sin necesidad de grandes medios técnicos.
Por otra parte, repasaremos otros métodos que permiten estudiar un número reducido de muestras, pero que presentan buenos índices de sensibilidad, especificidad y que no requieren gran equipamiento. Por último, veremos una técnica de referencia para todos los estudios serológicos, que precisa de mayor infraestructura y tiempo de realización, pero que debido a su importancia incluimos.
Los principales métodos que reúnen estas características son:
|
|
|
|
|
|
|
La técnica inmunoenzimática ELISA forma parte de aquellas reacciones serológicas que utilizan conjugados para poder visualizar la reacción ANTIGENO-ANTICUERPO. El ELISA, se basa en el uso de anticuerpos marcados con una enzima (generalmente la peroxidasa), de forma que los conjugados resultantes tengan actividad tanto inmunológica como enzimática. Al estar uno de los componentes (antígeno ó anticuerpo) insolubilizados sobre la placa, la reacción antígeno-anticuerpo quedará inmovilizada y por tanto, podrán fácilmente ser revelada mediante la adición del sustrato, que al actuar sobre la enzima, producirá un color observable a simple vista o cuantificable mediante un colorímetro.
Existen bastantes KITS comerciales disponibles y por tanto pueden realizarse estudios serológicos sin necesidad de grandes medios.

En la primera línea se observa el suero control positivo y en la segunda el negativo. Los sueros problema por duplicado han sido colocados en el resto de la placa, se observan positivos (azul) y negativos (sin color).
En la actualidad el ELISA es uno de los métodos más utilizados para el diagnóstico serológico de distintas enfermedades infecciosas porcinas.
El método ELISA está recomendado fundamentalmente para el estudio de poblaciones. Es una técnica altamente sensible y de gran especificidad, que permite realizar en un corto espacio de tiempo estudios sobre grandes poblaciones, de manera sencilla y económica. Esta técnica presenta además una buena reproducibilidad y facilidad en la interpretación de los resultados.
Se han adaptado varios tipos del método ELISA tanto para la determinación de ANTÍGENOS como de ANTICUERPOS:
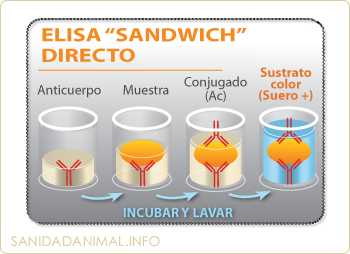
Fases de la técnica Elisa Sandwich. (1) Un anticuerpo monoclonal o policlonal anti antígeno suele estar ya unido a la placa. (2) se incuba con la muestra problema. (3) se añade el conjugado. (4) por último el sustrato. Todos los pasos van precedidos de incubaciones y lavados.
La modalidad más frecuente del método ELISA para la determinación de antígenos es el modelo ELISA "Sandwich". En esta forma, la placa suele ya venir con un anticuerpo fijado (monoclonal ó policlonal) frente al antígeno problema, sobre el que se añadirá el macerado del órgano sospechoso, que en caso de reaccionar con el anticuerpo de la placa, será puesto en evidencia tras la adición del segundo anticuerpo marcado con la enzima. Por último, se añade el substrato para revelar la reacción.
Para la determinación de anticuerpos específicos frente a un determinado antígeno se utilizan normalmente las siguientes modalidades del método ELISA:
- ELISA INDIRECTO.
- ELISA COMPETICIÓN.
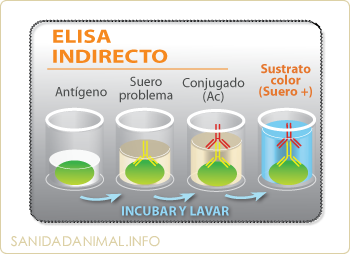
Fase de la técnica Elisa indirecto. (1) El antígeno se pega a la placa (2) Se añade el suero problema. (3) posteriormente, el conjugado. (4) y por último, el sustrato.
Es el método más utilizado para la determinación de anticuerpos. Básicamente, consiste en la inmovilización a la placa de ELISA del antígeno (en los Kits ya viene fijado) del que queremos conocer si en el suero problema existen anticuerpos específicos. Se pueden utilizar como antígenos, proteínas virales o bacterianas e incluso virus completos.
Cada día es más frecuente utilizar exclusivamente las proteínas de interés inmunológico y no todas las proteínas antigénicas. Los pasos siguientes serian la adición del suero problema, incubación y lavado, adición del conjugado, incubación y lavado, finalizando con la adición del sustrato, el frenado de la reacción y la lectura.

Fases de la Técnica Elisa de competición. (1) Se incuba el suero problema con el antígeno. (2) La mezcla anterior se deposita sobre los pocillos donde previamente se ha fijado un suero anti antígeno (3) se añade el conjugado. (4) después, el sustrato. En este caso la ausencia de color sería positivo.
En este sistema también es muy utilizado para la detección de anticuerpos específicos. Se parte de un anticuerpo (monoclonal o policlonal), frente a un antígeno conocido, que previamente ha sido inmovilizado en la placa. Se denomina de competición ya que el suero problema es incubado previamente con el antígeno, antes de incubarlo con el antisuero fijado en la placa, y por tanto compite con él.
Los pasos siguientes es la adición e incubación del conjugado, lavado y gfinalización con el sustrato y lectura.
foto Kit ELISA 1
Material necesario para la realización de la técnica de ELISA..
INMUNOELECTROTRANSFERENCIA O WESTERBLOT
La inmunoelectrotransferencia "westerblot" o "Immunoblotting" es una técnica inmunoenzimática que se utiliza para la detección de anticuerpos especificos. Se recomienda cuando no hay que estudiar un gran número de sueros o para analizar sueros dudosos por otras técnicas. Este método utiliza como soporte antigénico filtros de nitrocelulosa, donde las proteínas del antígeno han sido previamente transferidas, manteniendo total o parcialmente sus propiedades antigénicas.
Para la obtención de los filtros antigenados, las proteínas son separadas previamente mediante electroforesis en geles de poliacrilamida (SDS-PAGE) y transferidas a continuación, mediante corriente eléctrica, al filtro de nitrocelulosa. Este filtro es recortado en pequeñas tiras, que constituirán el soporte de tiras antigenadas. Sobre cada una de ellas se incubara el suero problema y los sueros control positivo y negativo. Tras un periodo de incubación y posterior lavado se agrega un conjugado anti inmunoglobulina G o M (según cual de ella se desee estudiar). Si hay inmunoglobulinas unidas a las proteínas antigénicas serán reveladas por el conjugado. Se podrá observar una o varias líneas de precipitación especificas según existan anticuerpos frente a una o varias proteínas. La especificidad se demuestra al reaccionar con las proteínas cuyo peso molecular coincida con las proteínas antigénicas.
Fase final de la técnica. Se pueden observar la aparición de las diferentes bandas con las que ha reaccionado el suero problema y los sueros control.
Es una técnica muy sensible, de fácil manejo, ejecución e interpretación. No necesita de equipos especial para su realización.
Esta técnica está fundamentalmente indicada en el estudio de un número no muy elevado de sueros. Al no necesitar ningún tipo de equipo especial, es de fácil realización incluso con pocas condiciones laboratoriales. En la actualidad existen varios Kits disponibles para distintas enfermedades, siendo cada día la oferta mayor.
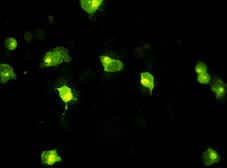
Técnica de inmunofluorescencia indirecta. Células MS infectadas con el virus de la Peste porcina africana. Se puede observar como los anticuerpos se han unido a la células infectadas, destacándose en el citoplasma unas zonas con una intensidad mayor, que corresponden a zonas de mayor replicación viral, y por tanto mayor fijación de anticuerpos.
LA INMUNOFLUORESCENCIA INDIRECTA O INMUNOPEROXIDASA
La inmunofluorescencia indirecta o la inmunoperoxidasa, según se utilice el isocianato de fluoresceína o la peroxidasa, son técnicas que utilizan la especificidad de la histología (pueden ver la célula y comprobar que la reacción inmunológica se produce en un sitio especifico) con la sensibilidad de las técnicas inmunológicas.
Estas técnicas utilizan normalmente cultivos celulares (primarios o de líneas estables) infectados con el virus o la bacteria sobre la que se desea comprobar si hay o no anticuerpos en el suero problema. Tras la incubación con el suero problema; si hay anticuerpos se unirán a las células infectadas pero no a las no infectadas (especificidad histológica observable). La unión se visualiza tras la adición de un conjugado anti-inmunoglobulina marcado con isocianato o con peroxidasa y la posterior observación al microscopio de fluorescencia o convencional respectivamente.
Tapiz celular infectado.
Fases de la Técnica Elisa de competición. (1) Se incuba el suero problema con el antígeno. (2) La mezcla anterior se deposita sobre los pocillos donde previamente se ha fijado un suero anti antígeno (3) se añade el conjugado. (4) después, el sustrato. En este caso la ausencia de color sería positivo.
Este método está considerado de referencia para cualquier estudio serológico pues es el que más se correlaciona entre la respuesta "in vitro" y la respuesta "in vivo". En esta prueba se puede valorar la capacidad que tienen los anticuerpos presentes en un suero problema para neutralizar la actividad biológica de un antígeno.
Los métodos descritos hasta ahora permiten valorar la capacidad que un suero determinado tiene para reconocer un antígeno concreto, en la seroneutralización se avanza un paso más y se indica la capacidad que tiene un suero para neutralizar la actividad biológica del antígeno. Estos métodos son ampliamente utilizados en los laboratorios para valorar la capacidad de un suero frente a toxinas bacterianas, bacteria y/o virus. Estas pruebas son más laboriosas, requieren de cultivos celulares, esterilidad, además de ser generalmente más lentas que todas las anteriores. Sin embargo son altamente especificas y sensibles, y se consideran las pruebas de referencia para cualquier valoración serológica.
En el caso de los virus, se puede medir la capacidad que un determinado suero tiene para neutralizar la infectividad del virus sobre una línea celular sensible. Se añade una mezcla de virus a una concentración constante que previamente ha estado en contacto con diferentes diluciones del suero problema sobre las células. Se van observando las células sobre la que se han añadidos las distintas diluciones para ver si el virus las ha infectado o no mediante la tinción con un conjugado o por el efecto citopático. De esta forma se puede medir la capacidad de neutralización viral de un suero problema.

