1. MARCADORES Y RECEPTORES DE MEMBRANA
1. MARCADORES Y RECEPTORES DE MEMBRANA.
Estos métodos han sido tradicionalmente utilizados para diferenciar y cuantificar poblaciones de linfocitos B y T. Con la disponibilidad de los anticuerpos monoclonales, frente a las distintas poblaciones linfocitarias porcinas, los métodos tradicionales se utilizan cada vez menos. Estos marcadores convencionales, están basados en las características específicas de ciertos receptores de membrana, presentes en ambas poblaciones de linfocitos. Los principales marcadores son:
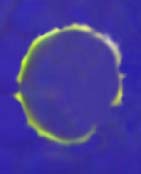
Observación, por microscopía de fluorescencia, de las inmunoglobulinas de superficie de un linfocito B
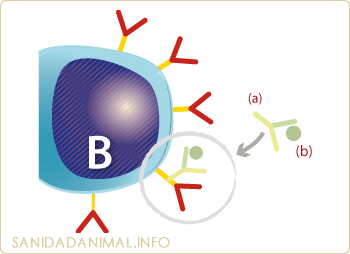
Esquema de la técnica para la observación de las inmunoglobulinas de superficie de un linfocito B. Un suero policlonal o monoclonal (a) marcado con isocianato de fluoresceína (b) reacciona con las inmunoglobulinas porcinas de la membrana.
Para los linfocitos B: En la membrana de los linfocitos B se encuentran inmunoglobulinas de superficie que pueden ser detectadas con un suero o inmunoglobulina antinmunoglobulinas porcinas marcados con fluorescencia o mediante un anticuerpo monoclonal, también marcado con isocianato de fluoresceína, contra cada isotipo de inmunoglobulinas. En el microscopio de fluorescencia se puede observar que en la membrana aparece una reacción fluorescente positiva.
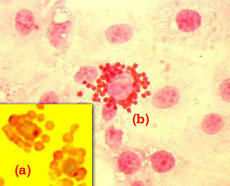
Es importante destacar que otro tipo de rosetas se puede formar en células porcinas. En la foto superior se puede observar la formación de rosetas con eritrocitos porcinos en macrófagos infectados con el virus de las Peste porcina Africana (b). Este fenómeno conocido como hemoadsorción no puede ser confundido con la formación de rosetas con eritrocitos de carnero de los linfocitos T porcinos (a).
Para los linfocitos T.
Rosetas con los eritrocitos. Los linfocitos T de cerdo, como los de otras especies, presentan la característica de formar rosetas cuando se unen a los eritrocitos de carnero (a). Se pueden cuantificar los linfocitos mediante el marcaje con naranja de acridina y la posterior observación al microscopio de fluorescencia y luz ordinaria a la vez. Los linfocitos T y B se marcan con la naranja de acridina, presentando los linfocitos T rosetas mientras que los B se marcan con la naranja de acridina pero no forman rosetas.
| Principales receptores utilizados tradicionalmente para diferenciar los linfocitos T de los B | |
| Linfocitos B: |
|
| Linfocitos T: |
|
2. ANTÍGENOS DE MEMBRANA
Mediante anticuerpos monoclonales se pueden marcar las diferentes poblaciones linfocitarias porcinas. Los métodos más utilizados son:
2.1. Análisis por citometría de flujo.
2.2. Inmunohistoquímica.

Fotografía de uno de los citómetros de flujo utilizados para el estudio de poblaciones de linfocitos porcinos. Se puede observar la unidad básica de lectura y el sistema de procesado de datos.
El citómetro de flujo es un aparato que permite caracterizar e incluso separar las diferentes poblaciones linfocitarias "in vitro" mediante el uso de anticuerpos monoclonales marcados con fluoresceína frente a los marcadores de superficie específicos de cada subpoblación que se desee estudiar. La citometría de flujo permite hoy día poder valorar varios fluorocromos a la misma vez, pudiéndose por tanto estudiar varias subpoblaciones celulares en la misma muestra de linfocitos. Para llevar a cabo el estudio, se puede partir de sangre completa (los modernos citómetros permiten trabajar con sangre completa) o de la población linfocitaria separada de la sangre. Las células, sobre las que se adicionan los monoclonales (se pueden valorar varios a la vez) frente al marcador objeto de estudio (CD2, CD4, CD8, etc.) pasan a través de un haz de un láser que detecta su capacidad para dispersar la luz (tamaño de las células) y la fluorescencia que emiten (tipo de célula). Las mediciones obtenidas se indican en porcentajes de cada población.
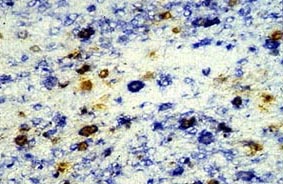
Estudio de doble marcaje (marrón-azul) para la localización de infección con el VPPA (marrón) en células marcadas con un antígeno monoclonal anti macrófago porcino (azul). Se puede observar como no todas las células que reaccionan con el AcM anti macrófago (azul) están infectadas, aunque si la gran mayoría.
2.2. Inmunohistoquímica. Utilizando anticuerpos monoclonales, marcados con fluorescencia o con peroxidasa, frente a los diferentes linfocitos porcinos, se puede valorar la situación de estas células en cualquier tejido. Incluso utilizando dos anticuerpos monoclonales, cada uno frente a una población linfocitaria distinta, y cada uno marcado con una enzima diferente (doble marcaje) (peroxidasa -fosfatasa alcalina) se pueden estudiar dos poblaciones celulares a la vez en cualquier tejido. Estas técnicas han sido de gran importancia para el estudio de la patogenia de varias enfermedades infecciosas del ganado porcino. Así por ejemplo, se pudieron estudiar las poblaciones linfocitarias porcinas que estaban o no afectadas por el virus de la Peste porcina africana (VPPA) en diferentes órganos, así como el VPPA afectaba la expresión de los SLA, en los macrófagos infectados. En la actualidad estas técnicas son de gran utilidad para conocer las poblaciones afectadas en las diferentes infecciones víricas y llevar a cabo estudios de patogenia.
Estos métodos de estudios se basan en valorar la capacidad que tanto los linfocitos T como los B tienen para reconocer a un antígeno determinado. Las técnicas más utilizadas son:
- Estimulación blástica o Blastogénesis
- La actividad citotóxica de los linfocitos T (CD 8+)
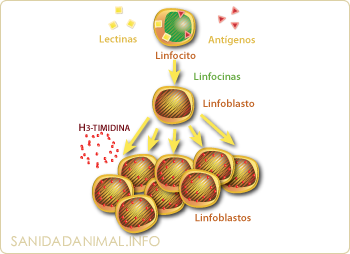
Esquema de la estimulación blástica o blastogénesis.
ESTIMULACIÓN BLÁSTICA O BLASTOGÉNESIS.
La estimulación blástica o blastogénesis. La utilización de la transformación linfocitaria o blastogénesis es actualmente una de las técnicas más precisas y difundidas para el estudio de la capacidad de estimulación específica y no específica de los linfocitos "in vitro". Esta técnica se basa en la capacidad que los linfocitos tienen para responder frente a un antígeno (respuesta específica) que por vacunación o por sufrir una infección, ha inducido linfocitos memoria. Estos linfocitos al estar de nuevo en contacto con el antígeno inducen una transformación blástica. Esta estimulación blástica también puede ser inducida de forma no específica gracias a la capacidad de los linfocitos de reaccionar con diferentes tipos de lectinas o mitógenos. Las lectinas inducen una estimulación blástica de tipo inespecífico tanto en los linfocitos B como en los T.

Fotografía de un equipo para la recogida de células cultivadas en placa ("Harvester"). Las células quedan en el papel de filtro. Estos filtros se pasarán al contador de centelleo líquido o de partículas β.
El método de la blastogénesis consiste, en resumen, en cultivar los linfocitos de un animal con los antígenos que quieren ser evaluados o estudiados y con varios mitógenos que se utilizan como control de la inmunoproliferación (estimulación no específica). La transformación blástica específica se mide por la capacidad que tiene el antígeno de inducir inmunoproliferación.
Tras un tiempo de incubación determinado se añade un isótopo radioactivo (timidina-tritiada) al medio de cultivo donde están los linfocitos. Si hay estimulación blástica (inmunoproliferación) la timidina se incorporará a los nuevos linfocitos, quedando por tanto las células marcadas radiactivamente.
Mediante un recogedor especial de células ("Harvester") se toman las células y el sobrenadante de cada pocillo y se pasan por un filtro donde sólo quedaran las células. Estos filtros serán posteriormente llevados a un contador de centelleo líquido o de partículas β. Cuanta más incorporación de timidina-tritiada mayor estimulación blástica.
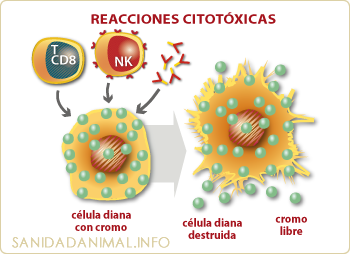
Esquema para los estudios de citotoxicidad en sus diferentes formas de inducción: Por linfocitos CD 8+, por células NK y por inmunoglobulinas que activan complemento. Su valoración se realiza por liberación del cromo 51 en un contador de partículas radioactivas γ al ser destruida la célula diana.
LA ACTIVIDAD CITOTÓXICA DE LOS LINFOCITOS T (CD 8+)
La actividad citotóxica de los linfocitos T (CD 8+) frente a una célula diana se puede estudiar, midiendo la capacidad de destrucción, que un determinado número de linfocitos T tienen para destruir un determinado número de células diana, al estar ambas poblaciones en contacto. Hay varios métodos para poder valorar el porcentaje de lisis o muerte celular que expresan las células diana, aunque el más utilizado por su precisión, sensibilidad y reproducibilidad, es el de la liberación de cromo 51 procedente de las células diana. Este método consiste, brevemente, en lo siguiente: Las células diana (que expresan los antígenos determinados en su membrana) son marcadas con Cromo 51 y puestas en contacto en una proporción adecuada con las células efectoras (CD 8, NK, etc). Tras incubar ambas poblaciones celulares conjuntamente por un periodo de incubación determinado, se centrifugan y seguidamente una parte del sobrenadante resultante es medido mediante un contador de partículas gama para conocer el porcentaje de cromo 51 liberado al medio. A mayor cantidad de cromo liberado mayor actividad citotóxica.

