Se encuentran en el suero y fluidos tisulares de todos los mamíferos en forma de secreción (ANTICUERPOS) o unidas a la membrana de los linfocitos B (RECEPTOR BcR). Son las mediadoras de la respuesta humoral. En el cerdo se han descrito cuatro tipos de inmunoglobulinas, denominadas:
IgM, IgG, IgA e IgE.
¿COMO SE PRODUCEN LAS INMUNOGLOBULINAS?
Las inmunoglobulinas son producidas tras la estimulación de un linfocito B (por antígenos T dependientes o T independientes) y la posterior transformación en célula plasmática. La células plasmáticas no se dividen, tampoco cambian de isotipo, ni expresan SLA II, ni inmunoglobulinas en su superficie. Por tanto, no pueden interaccionar con ningún tipo de antígeno. Son células-factoría de Inmunoglobulinas.
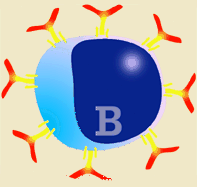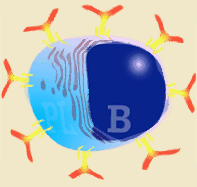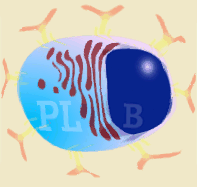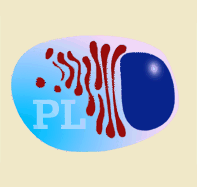
Esquema de linfocito B y su transformación en célula plasmática
Dada la enorme complejidad estructural que tienen la mayoría de los antígenos, cuando se produce una respuesta humoral frente a cualquiera de ellos, se inducen un gran número de anticuerpos distintos dirigidos a los diferentes epítopes que componen el antígeno inductor de la respuesta inmune. Por ello, la respuesta inmune humoral es policlonal, ya que hay miles de clones estimulados y secretando anticuerpos distintos.
| La respuesta inmune mediada por anticuerpos, se denomina respuesta humoral. |
| La respuesta humoral es policlonal y puede ser una respuestas primaria o secundaria |
Las inmunoglobulinas producidas por cada clon de células plasmáticas serán específicas frente al epítope inductor de la respuesta inmune. Existirán tantos clones productores de anticuerpos como epítopes hayan inducido la respuesta inmune. En una respuesta inducida por un antígeno (formado por varios epítopes) habrá diferentes clones de células plasmáticas segregando anticuerpos específicos para cada epítope.
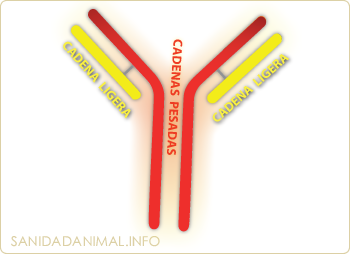
Estructura básica de las inmunoglobulinas formada por dos cadenas pesadas (rojo) y dos cadenas ligeras (amarillo)
¿CÓMO ES LA ESTRUCTURA DE LAS INMUNOGLOBULINAS?
Estructuralmente, las inmunoglobulinas de cerdo, al igual que en otras especies, son glicoproteínas formadas básicamente por cuatro cadenas polipeptídicas. Dos de ellas, denominadas PESADAS o cadenas H (Heavy: pesado), con un peso molecular de entre 55 a 77 kilodalton (kDa) y dos LIGERAS o L (Light: Ligera) con un peso molecular de entre 23 a 26 kDa. Las dos cadenas H y las dos L mantienen idéntica estructura entre ellas. Las dos cadenas pesadas se unen entre si covalentemente mediante puentes de azufre y la cadena pesada se une a la ligera mediante un puente disulfuro. Cada una de las cadenas consta de una región constante y otra variable.
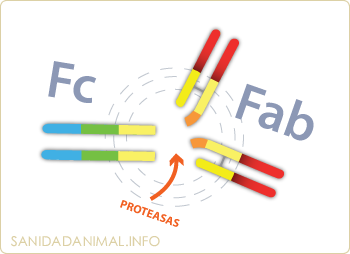
Si una molécula de inmunoglobulina es tratada por proteasas, como la pepsina o la papaina, se parte en dos fragmentos denominados: Fab, de las palabras inglesas "antigen binding Fragment" y Fc (Crystalizable Fragment). En el primer fragmento (Fab), reside la especificidad de la inmunoglobulina, y por tanto su capacidad para reaccionar con el antígeno, mientras que el segundo fragmento (Fc) realiza las funciones efectoras de las inmunoglobulinas (fijación del complemento, receptores celulares, etc.)
Tanto las cadenas pesadas como las ligeras, están formadas por unas estructuras proteicas conservadas denominadas "Dominio de Inmunoglobulinas". Estos dominios están formados por aproximadamente 110 aminoácidos. Las cadenas ligeras están formadas por dos dominios, uno variable (VL) y otro constante (CL) y las cadenas pesadas por una parte variable (VH) y tres (IgG e IgA) o cuatro (IgM e IgE) constantes (CH1, CH2, CH3 y CH4). Los dominios son idénticos en las dos cadenas ligeras entre si y en las dos cadenas pesadas.
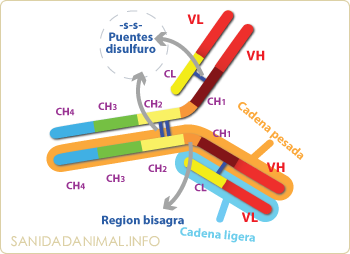
Estructura de los dominios de las inmunoglobulinas. En las cadenas ligeras existen dos dominios,uno variable (VL) y otro constante (CL). Las cadenas pesadas presentan un dominio variable (VH)y tres o cuatro constantes (CH).
En las cadenas H también existe una región adicional, que no forma parte de los dominios, denominada región bisagra. La región bisagra está localizada entre los dominios CH1 y CH2 y permite la movilidad a las inmunoglobulinas.
El análisis de aminoácidos de la región bisagra demuestra que está formada por un gran numero del aminoácido prolina lo que permite su flexibilidad, pero también su susceptibilidad al ataque de proteasas, de ahí, su fragmentación en Fab y Fc.
Los dominios variables (VL y VH) tienen como función la unión al antígeno y por tanto, son los responsables de la especificidad de la inmunoglobulina, mientras que los dominios constantes permiten la diferenciación de los cinco isotipo de cadenas pesadas (μ,γ,ε,α,δ) que formaran las inmunoglobulinas (IgM, IgG, IgE, IgA e IgD) y de los dos tipos de cadenas ligeras: capa (Κ) y landa (λ). Así como, son los responsables de las funciones efectoras de las inmunoglobulinas (fijación del complemento, receptores celulares, etc.)
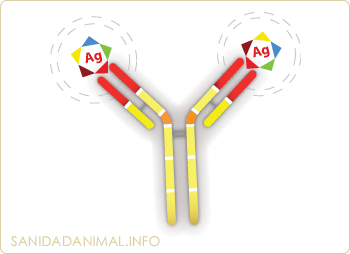
Localización de los sitios de unión con el antígeno
La variabilidad observada en las zonas variables de ambas cadenas (L y H) se localiza en tres segmentos, de alrededor de 10 aminoácidos, denominados regiones hipervariables, también conocidos como: CDR1, CDR2 y CDR3 (Complementary Determining Regions o Región determinante de Complementariedad). Estos segmentos forman el denominado sitio de unión con el antígeno. Por lo tanto, cada molécula de inmunoglobulina tiene dos sitios de unión con el antígeno.
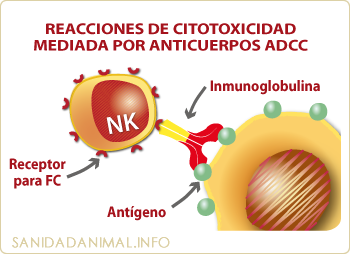
Esquema dela reacción de citotoxicidad mediada por anticuerpos. La especificidad la proporciona el anticuerpo y la acción citotóxica la célula
Por otra parte, en la estructura de las inmunoglobulinas también juega un papel importante los hidratos de carbono, sobre todo en la región constante de las cadenas pesadas, y en particular en la zona CH2 y en la región bisagra, aunque en las regiones variables de las cadenas pesadas sólo representa alrededor de un 15%. El papel de los azucares no esta del todo claro, pero parece ligado a su catabolismo y también afecta a alguna de sus funciones, así se ha podido comprobar que las IgG deglicosiladas pierden o disminuyen su capacidad para unirse a receptores celulares e inducir ADCC, así como para activar el complemento.

