|
Arias, M.,
Sánchez, C., González,
M.A., Carrasco, L. y Sánchez-Vizcaíno,
J.M.
| Reservorios y animales susceptibles |
|
El cerdo
es la única especie doméstica que se infecta
naturalmente por el vPPA. Los
jabalís europeos son también susceptibles a
la infección, con síntomas clínicos
y mortalidad similar a la observada en cerdos domésticos
. Por el contrario, los suidos
africanos presentan usualmente infecciones
de tipo subclínico e inaparente. actuando como reservorios
de la enfermedad.
|
|
|
|
|
|
El virus
de la Peste porcina africana replica también en un
tipo de garrapatas,
que actúan como vectores
biológicos y son reservorios
del virus, el Ornitodorus moubata en África y el Ornitodorus
erráticus en la Peninsula Iberica.
El vPPA es el único
virus DNA entre los arbovirus.
|
| Existen importantes diferencias
epidemiológicas entre Africa y Europa. En
Africa, el vPPA se mantiene por un ciclo
de infección entre jabalís
salvajes africanos y vectores biológicos, O. Moubata,
presente en numerosas regiones del Africa subsahariana, lo que
dificulta su erradicación. Solamente cuando están
presentes cerdos domésticos se observan signos clínicos
y mortalidad. Por el contrario, los jabalíes europeos
son susceptibles a la infección por vPPA pero en este
caso los animales muestran síntomas clínicos y
mortalidad similar a las observadas en los cerdos domésticos.
La dinámica epidemiológica
de jabalís y cerdos domesticos también es muy
similar, siendo la ruta de infección más común
el contacto directo entre animales enfermos y sanos.
La transmisión indirecta por vectores
biológicos como O. erraticus se ha descrito en
la Peninsula Ibérica especialmente en las explotaciones
de extensivo. |
|

Facoquero (Phacochoerus aethiopicus).
Es una de las especies de suinido africano salvaje más
frecuente.
|
|
|
|
Otras diferencias importantes
entre Africa y Europa están relacionadas con el vPPA
y los vectores biológicos. En Africa, O. Moubata
transmite el virus por ruta transovarica y transestadial mientras
en Europa solo se ha observado transmisión transestadial
en el O. erraticus.
Tradicionalmente la vía
de entrada del virus en áreas libres se ha producido
a través de desechos no cocinados de origen porcino
que han servido de alimento para otros cerdos, especialmente
restos de alimentos de aviones y barcos.
|
| Una vez
establecida la enfermedad en un país, su difusión
se debe principalmente al contacto directo entre animales
enfermos y sanos. Los
cerdos portadores, recuperados de la infección, juegan
un papel fundamental en la transmisión de la enfermedad.
El virus puede ser transmitido por via
indirecta vehiculado en camiones, bebederos, comederos,
material quirúrgico, personal, roedores, otros animales
presentes en la explotación, etc, así como mediante
vectores biológicos.
|
| Principales factores
implicados en la transmisión de la PPA: |
|
Contacto directo entre cerdos sanos y enfermos.
|
|
Animales portadores.
|
|
Via indirecta: Transporte, bebederos, comederos,
material quirúrgico, personal (ropas, calzados),
roedores, otros animales presentes en la explotación,
etc, así como mediante vectores biológicos.
|
|
|
| Principales vías
de eliminación del vPPA: |
|
Secreciones nasales
|
|
Saliva
|
|
Heces
|
|
Orina
|
|
Exudado conjuntival
|
|
Exudado genital
|
|
Heridas sangrantes
|
|
|
El virus
comienza a eliminarse incluso antes de que aparezcan los primeros
síntomas, durante el período de incubación.
Durante la fase aguda de la infección el título
de virus en tejidos y sangre es muy elevado, manteniéndose
la viremia durante la convalecencia.
|
|

Imagen de microscopía
electronica donde se observa el vPPA asociado a eritrocito.
|
|
En productos carnicos, el vPPA
puede persistir durante varias semanas o meses en carnes no
cocinadas o congeladas.
En productos elaborados como el jamón
de Parma, la inactivación se ha demostrado a partir
de 300 días del proceso de curación. En
productos curados españoles, jamón serrano,
jamón y paletilla de ibérico y lomo el período
de supervivencia del vPPA es inferior al período establecido
para la curación comercial de cada producto.
|
|
| Inactivación
del vPPA en productos elaborados porcinos |
| |
Tiempo
(días) de Curación comercial |
Tiempo
(días) de Inactivación del vPPA |
| Jamón
serrano |
180-365
|
140
|
| Jamón
Ibérico |
365-730
|
140
|
| Paletilla
Ibérica |
240-420
|
140
|
| Lomo
Ibérico |
90-130
|
112
|
En jamones cocinados o
cocidos no se ha encontrado virus infeccioso cuando estos
productos se tratan por calor a 70 °C.
|
|
Pulse sobre
la imagen para ver la animación
|
|
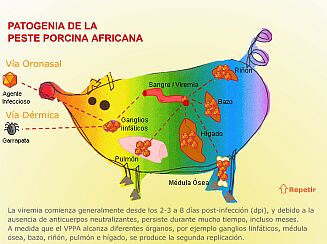
La entrada del VPPA en el cerdo
normalmente ocurre por vía oronasal,
aunque son también posibles otras rutas como la cutánea
(por escarificación), la intramuscular,
subcutánea e intravenosa debido a la picadura de garrapatas.
El período de incubación varía en un
rango de 3 a 21 días, dependiendo del aislado y de
la ruta de exposición. La replicación primaria
tiene lugar en los monocitos y
macrófagos de los ganglios
linfáticos más próximos al lugar de entrada
del virus. Los monocitos y macrófagos
de las tonsilas y de los ganglios linfáticos mandibulares
son los primeros afectados si la infección es oral.
Desde estos lugares, los virus
se diseminan por vía sanguínea,
asociados a las membranas de los hematíes, y/o
por vía linfática.
|
| La viremia comienza generalmente
desde los 2-3 a 8 días post-infección (dpi), y
debido a la ausencia de anticuerpos neutralizantes,
persiste durante mucho tiempo, incluso meses. A medida que el
VPPA alcanza diferentes órganos, por ejemplo ganglios
linfáticos, médula ósea, bazo, riñón,
pulmón e hígado, se produce la segunda replicación. |
| Replicación del virus
y efecto citopático |
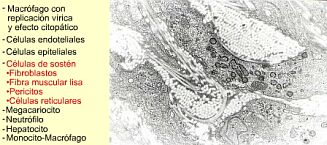
| Las principales células
diana del virus de la PPA son las células pertenecientes
al Sistema Mononuclear Fagocítico
(SMF) que sufren un efecto citopático,
caracterizado por el redondeamiento del núcleo, marginación
periférica de la cromatina y vacuolización del
sistema vacuolar que culmina con la necrosis de la célula
con replicación vírica. Una de las consecuencias
del efecto citopático inducido por el virus es la hemoadsorción
(adsorción de hematíes de cerdo alrededor de los
macrófagos infectados por el virus), y al que se ha responsabilizado
del transporte pasivo de los virus por los eritrocitos. |
|
Pero el virus de la PPA, no solo
induce la necrosis de las células del SMF, sino también
una intensa activación y liberación de mediadores
químicos de la inflamación por estas células,
principalmente en las fases iniciales de la enfermedad. Aunque
el monocito-macrófago es la principal célula
diana del virus de la PPA, se ha descrito la replicación
vírica en otras poblaciones celulares, por lo que actualmente
se le considera como un virus pantotropo.
|
|
Pulse sobre la imagen para
ampliar.
|
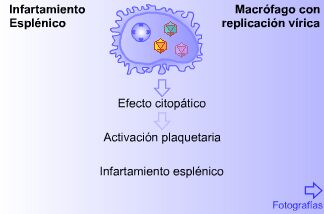
| La pulpa esplénica
roja del bazo de cerdo está constituida por los senos
venosos y los cordones de Billroth. Los cordones de Billroth
conforman una red tridimensional cuyas trabéculas en
el cerdo están formadas por fibras musculares lisas tapizadas
por células macrofágicas, por lo que en el bazo
de cerdo existe una población macrofágica fija. |
Pulse sobre la imagen para ampliar.
|
|
Durante la infección
con aislados muy virulentos existe, desde los primeros días,
una intensa replicación del virus en estos macrófagos
que sufren, al igual que otras poblaciones macrofágicas,
el efecto citopático del mismo, por lo queda al descubierto
la membrana basal de estas fibras, a la que se agregan de inmediato
plaquetas activadas y redes de fibrina, provocando una coagulación
difusa por todo el bazo. Esta coagulación en el interior
del bazo tiene como consecuencia inmediata una parada en la
circulación de retorno mientras que la sangre arterial
sigue entrando, lo que da lugar a una infartación hemorrágica.
Esta infartación hemorrágica puede ser incompleta
o, incluso, faltar en infecciones con cepas de moderada virulencia,
ya que el efecto citopático del virus es menor. |
|
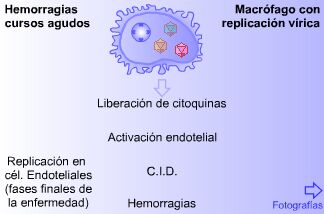
Las hemorragias son, junto con
las lesiones esplénicas, las lesiones más características
y constantes de la PPA. Las hipótesis que intentan
explicar el mecanismo patogénico de conduce a un estado
final de "shock" han sido varias, conjugándose
la acción directa del virus sobre el endotelio y la
coagulación intravascular diseminada (CID), pero la
instauración de estos procesos es anterior a la replicación
del virus de la PPA en las células endoteliales, por
lo que esta causa fue rechazada como origen de las hemorragias.
La aparición de las hemorragias coincide, sin embargo,
con una intensa activación fagocítica de las
células endoteliales, un incremento de las fenestraciones
de las paredes de los capilares, la existencia de depósitos
subendoteliales y la pérdida de células endoteliales,
lo que conlleva la exposición de la membrana basal
y la consecuente activación plaquetaria y desencadenamiento
de un proceso de coagulación intravascular.
|
|
Estas lesiones endoteliales constituyen
la manifestación morfológica de los cambios
bioquímicos indicativos de disfunción, como
niveles altos de factor VIII y reducción de los valores
de prostaglandinas. Las citoquinas liberadas por los macrófagos
y monocitos activados pueden también jugar un papel
importante en el establecimiento de la CID, ya que estas células
se han observado en la vecindad de los vasos dañados.
Sin embargo, en los cursos subagudos de la enfermedad, en
los que las hemorragias son más intensas y difusas,
no existe daño endotelial ni coagulación intravascular
diseminada, estando las hemorragias, en estos cursos, asociadas
a una intensa vasodilatación e incremento de la permeabilidad
vascular, lo que también justifica la aparición
de edemas intersticiales.
|
|
Pulse sobre la imagen para
ampliar.
|
|
|
|
El incremento
del número de linfocitos en apoptosis presente en los
cursos agudos de la PPA ha sido considerado, recientemente,
como el responsable de la linfopenia observada en estas formas
de la enfermedad. Esta muerte celular programada sería
la responsable de la linfopenia, agravada inicialmente por la
inhibición de la proliferación de linfocitos inducida
por el virus, y, en las fases finales de la enfermedad, por
la destrucción de las estructuras linfoides en bazo,
ganglios linfáticos y tonsilas como consecuencia del
daño vascular. Varios son los mecanismos que pueden dar
origen a la apoptosis en las enfermedades víricas, atribuyéndose
en el caso de la PPA a la síntesis y liberación
de diferentes monoquinas por los monocitos-macrófagos
activados y/o macrófagos con replicación vírica.
|
| El hecho de que la apoptosis
sea más extensa en el tejido linfoide difuso, en el que
los macrófagos activados, conteniendo o no sitios de
replicación vírica, son más numerosos,
apoya esta hipótesis; paradójicamente el virus
de la PPA contiene un gen que inhibe la apoptosis de las células
en las que se replica. |
| En las formas agudas de la
PPA se presenta una trombocitopenia en la fase final de la enfermedad,
después de que las hemorragias sean muy evidentes, aunque
a menudo pasa desapercibida debido a la muerte de los animales,
y que es el resultado de un daño importante en la médula
ósea como resultado de la replicación del virus
en las células estromales y hematopoyéticas. En
las formas subagudas es característico, sin embargo,
la existencia de una trombocitopenia transitoria, durante las
fases inicial y media de la enfermedad, y que participa activamente
en la aparición de las hemorragias y puede ser la causa
de la muerte de los animales, si estos no superan esta fase
trombocitopénica. |
|
La aparición de esta trombocitopenia
en los cursos subagudos está relacionada con tres estados
o fases de los megacariocitos: una fase "compensatoria",
caracterizada por la presencia en los megacariocitos de abundantes
proyecciones citoplasmáticas, que coincide con un consumo
periférico de plaquetas en la fase inicial de la enfermedad;
una fase de "hipermadurez o agotamiento", representada
por la abundancia de megacariocitos en apoptosis (también
llamados "megacariocitos desnudos"), no relacionada
con la replicación del virus en estas células,
y que provocaría una súbita y grave trombocitopenia,
al no producirse la liberación de plaquetas al torrente
circulatorio; y una tercera fase "regenerativa",
en la que se observan nidos de células en las que se
replica, lo que indica una recuperación de la población
de megacariocitos y por tanto el fin a la trombocitopenia.
|
|
|
 Imprimir
Imprimir
|