| Como para otras enfermedades
infecciosas la identificación de la enfermedad en
el laboratorio se puede establecer mediante la detección
del virus o de sus restos moleculares, así como mediante
la detección de los anticuerpos específicos. |
| Antes de analizar las
diferentes técnicas utilizadas para el diagnóstico
laboratorial conviene recordar qué tipo de muestra
son necesarias y cómo deben ser tomadas y remitidas
al laboratorio. |
| Toma y envío de
muestras: |
|
Para
establecer un diagnóstico correcto de la enfermedad
es necesario enviar al Laboratorio
de Referencia las muestras en condiciones
adecuadas para permitir la conservación del virus.
| En el caso de la
FA las muestras de elección
son las siguientes: |
Estas muestras han de ser recogidas de forma estéril
y debe tenerse mucha precaución para que las mismas
no entren en contacto con ningún desinfectante
que pudiera producir una inactivación viral. El
virus también se puede inactivar
debido a modificaciones del pH, por lo que las
muestras de epitelios, saliva y líquido vesicular
se deberán remitir incluidas en un medio
de transporte con capacidad tampón que garantice
la estabilidad del pH entre 7,2 y
7,6.
|
|
Debido
al riesgo biológico que supone el manejo de estas
muestras, el envío
de las mismas al laboratorio deberá realizarse en
adecuadas condiciones de bioseguridad.
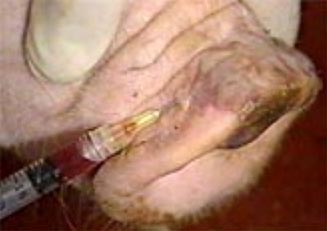
Extracción del liquido
de la vesícula aftosa. Este material presenta un
gran numero de partículas virales.
|
| Técnicas para
la detección e identificación del virus/antígeno: |
|
Suspensiones de muestras de campo sospechosas de contener
VFA deben ser clarificadas e inoculadas en cultivos celulares.
Se pueden utilizar líneas
celulares establecidas como BHK-21 e IBRS-2, o cultivos
primarios de células de tiroides bovino, muy sensibles
al VFA, donde el virus produce un efecto citopático
(ECP) en las células infectadas. Los sobrenadantes
obtenidos de los cultivos que muestren ECP se deberán
examinar posteriormente mediante ELISA
de captura de Antígeno para confirmar la
presencia del VFA en las muestras y determinar el serotipo.
|
|
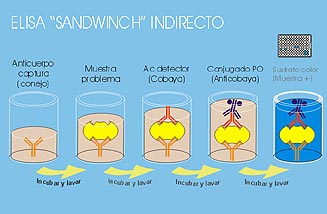
Esquema del ELISA Sandwich Indirecto.
Pulse sobre la imagen para verla a tamaño real
|
| Es importante destacar
que el material enviado al laboratorio para la realización
del diagnóstico ha de ser de gran calidad y debe
haber sido enviado en condiciones óptimas de conservación,
especialmente en cuanto al mantenimiento de un adecuado
pH y temperatura, porque muchas veces el resultado negativo
puede ser debido a una mala calidad de las muestras y no
a una ausencia del virus en el animal. |
|
Para la identificación se
emplean técnicas de fijación de complemento
(FC) o ELISA de captura de antígeno. La
FC es una técnica que actualmente ha sido sustituida
en la mayoría de los laboratorios por el ELISA
de antígeno, que es más rápido,
fácil de realizar, más especifico, más
sensible y permite el análisis de un mayor numero
de muestras.
Los ELISAs utilizados son de tipo
sandwich indirecto frente a diferentes serotipos de FA,
que poseen una sensibilidad limitada y detectan a partir
de títulos superiores a 104 DITC50/ml.
|
| Detección del
ácido nucleico viral |
|
Las técnicas de PCR
(reacción en cadena de la polimerasa) permiten
la detección del RNA del virus mediante la amplificación
de fragmentos específicos de genoma del VFA en
muestras de fluidos vesiculares, epitelios de aftas, saliva,
hisopos, suero o sangre completa (con EDTA), procedentes
de animales infectados. Este método presenta una
sensibilidad y especificidad muy elevada, pudiendo realizar
un diagnóstico positivo en muestras de sangre completa
obtenidas a partir del 2º día de la infección
del animal, si bien el periodo de viremia resulta muy
corto, durando un máximo de 3 a 5 días.
|
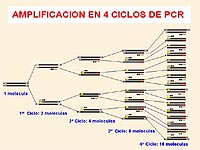
|

Esquema de un ciclo de PCR.
Pulse sobre la imagen para ver la animación
|
|
Secuencia de amplificación de ADN
durante la PCR.
Pulse sobre la imagen para verla a tamaño
real
|
|
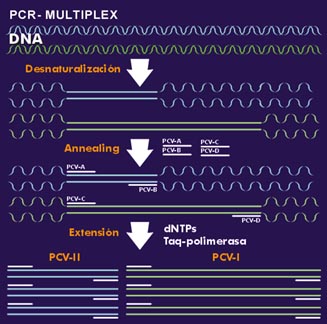
Esquema de PCR múltiplex
para dos virus diferentes.
Pulse sobre la imagen para verla a tamaño real
|
|
Mediante estas
técnicas moleculares, y concretamente mediante la
RT-PCR, es posible identificar específicamente el
serotipo utilizando oligonucleótidos seleccionados
de regiones muy variables correspondientes a la proteína
estructural VP1.También se dispone de una técnica
de PCR múltiplex
que permite la diferenciación específica mediante
un único ensayo de las tres principales enfermedades
vesiculares: Fiebre Aftosa, Enfermedad Vesicular del Cerdo
y Estomatitis Vesicular. |
|
Los cebadores empleados en la PCR pueden ser generales
de VFA, con los cuales podremos detectar todos los serotipos
de VFA, o específicos de serotipo, con los que
se detectarán exclusivamente los virus de un serotipo
determinado. El producto amplificado mediante esta técnica
se puede secuenciar con objeto de realizar estudios de
epidemiología molecular que nos permitan determinar
el origen de un virus mediante la elaboración del
correspondiente árbol filogenético.
|
|
Árbol filogenético
del virus inductor del brote de Fiebre aftosa del reino
Unido del año 2001.
Pulse sobre la imagen para verla a tamaño real.
|
| Métodos para la
detección de anticuerpos |
| Las técnicas más utilizadas
en la actualidad para la detección de anticuerpos
específicos de FA son: la Veroneutralización
(VN) y el ELISA sandwich de bloqueo en fase líquida.
La VN es
una técnica sensible, específica, cuantitativa
y que permite la identificación especifica de serotipo.
Es la técnica de referencia y está
recomendada para la confirmación de sueros positivos
o dudosos a ELISA, pues por su laboriosidad y necesidad
de utilización de cultivos celulares no permite
el estudio sobre un número elevado de muestras.
Otros dos inconvenientes añadidos son la necesidad
de un mínimo de 2-3 días para la realización
de esta técnica, lo que retrasa el diagnóstico,
y la necesidad de emplear virus vivo de FA, lo que implica
la necesidad de emplear laboratorios con niveles de bioseguridad
elevado debido al riesgo de escape de virus.
|
|
El ELISA de bloqueo en fase líquida (ELISA-LPB)
es una técnica sensible, específica,
cuantitativa y que permite también la identificación
del serotipo. Es la técnica de elección
para el estudio de un gran número de muestras.
Otras ventajas frente a la VN son su rapidez para obtener
un diagnóstico serológico (tan sólo
unas horas), su reproducibilidad y su independencia del
empleo de cultivos celulares. Detecta animales
positivos a partir del 4º día post-infección,
si bien, al igual que en la VN, se deben emplear reactivos
específicos para cada serotipo, por lo que en realidad
se deberían realizar 7 ELISAs para garantizar un
resultado negativo (frente a los serotipos A, O, C, SAT1,
SAT2, SAT3 y Asia1). Este ELISA detecta
tanto anticuerpos frente a proteínas estructurales
como no estructurales, por lo que tanto los animales infectados
como los vacunados frente al VFA resultarán positivos
sin poderse diferenciar.
|
|
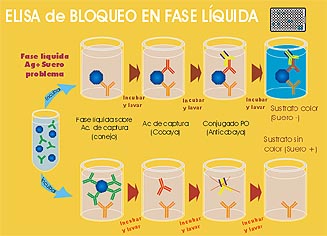
Esquema de ELISA de Bloqueo
en Fase Líquida para detección de anticuerpos
frente a proteínas estructurales y no estructurales
del VFA.
Pulse sobre la imagen para verla a tamaño real
|

Esquema del ELISA 3ABC para la detección
de anticuerpos frente a proteínas no estructurales
del VFA.
|
|
Nuestro laboratorio
(CISA-INIA) ha participado muy activamente en el desarrollo
y puesta a punto de una técnica
de ELISA indirecto que emplea como antígeno una proteína
no estructural muy inmunogénica del VFA (3ABC recombinante
producida en E. Coli), que permite la diferenciación
eficaz entre animales vacunados e infectados, con
un buen nivel de sensibilidad y especificidad. Este ELISA-3ABC
es fácil de realizar, rápido,
no necesita utilizar anticuerpos monoclonales y permite
su uso para el análisis de sueros de distintas especies
(ovejas, vacas, cerdos) simplemente cambiando el reactivo
detector de la prueba (conjugado). |
| Igualmente, se han desarrollado
en otros laboratorios diferentes ELISAs que permiten la
detección de anticuerpos frente a proteínas
no estructurales del VFA, unos utilizando la proteína
3ABC completa y otros utiliza péptidos sintéticos
de las proteínas no estructurales. |
 Imprimir
Imprimir
|