| Aunque la historia clínica,
los datos epidemiológicos y los antecedentes pueden
resultar muy orientativos en el diagnóstico
de la enfermedad de Glässer, solo el laboratorio es
conclusivo. |
|
El aislamiento
es una cuestión capital, como en otros microorganismos
del grupo, aunque no siempre sea una empresa fácil,
a lo que se suma el hecho de que otros microorganismos
de más fácil supervivencia y multiplicación
en las mismas muestras clínicas, pueden 'ocultar'
o 'enmascarar' la presencia de H. parasuis. Los
mejores resultados se obtienen cultivando fluidos, exudados
o líquidos procedentes de varios tipos de membranas
serosas, incluyendo líquido cefalorraquídeo
y sangre, procedente del corazón, aunque
no se observen lesiones sospechosas. Del mismo modo puede
utilizarse, también, líquido ascítico,
de la cavidad torácica, líquido pericárdico
o articular, hisopos nasales o traqueales o parénquima
pulmonar. Proporcionan buen resultado
hisopos o escobillones impregnados en el material clínico
descrito. El tiempo transcurrido entre la toma
de muestras y las inoculaciones en medios de cultivo,
para el aislamiento, posee gran importancia. Si se prevé
más allá de 24 horas de demora, es muy conveniente
la utilización de hisopos con medio de transporte,
que mejoran sustancialmente la supervivencia del agente
y facilitan la recuperación.
|
|

Figura 7. Los
hisopos o escobillones son muy útiles en el diagnóstico.
Permiten la toma de muestras, su envío y la utilización
directa para la siembra en los medios de cultivo.
|
| En el laboratorio, para
el aislamiento, se recomienda un medio base para agar sangre,
enriquecido con triptosa, con un 5% de sangre de caballo
desfibrinada. Se utiliza una estría nodriza
de St. aureus o St. epidermidis sobre la que
se inocula el material de prueba. Como se ha señalado
en otro lugar, se puede utilizar también agar chocolate
u otras opciones como el agar PPLO o el agar de Levinthal
o el de Gilbride y Rosendal (agar tripticasa-soja), enriquecidos
mediante la adición de 0'025% de NAD, suero de caballo,
extracto de levadura y glucosa. Cualquier fórmula
puede hacerse selectiva mediante la incorporación
de lincomicina o bacitracina Las condiciones de cultivo
incluyen un periodo de incubación de 24-48 horas
a 37ºC y 5% de CO2. |
| Solo
el aislamiento proporciona seguridad en el diagnóstico,
a lo que se suma el hecho de que un mismo animal puede estar
infectado, simultáneamente, por varios serotipos
diferentes, por lo que la recuperación a partir de
distintos órganos adquiere una importancia particular.
|
|
La
diferenciación con otros microorganismos próximos
puede llevarse a cabo mediante procedimientos de cultivo
convencionales e incluso mediante la utilización
de procedimientos rápidos en microceldillas complementados
con la información procente de los medios con sangre
(hemólisis y CAMP). A este respecto, es conveniente
la diferenciación de A. minor, A. indolicus,
A. porcinus y Haemophilus taxón C
que, no siendo patógenos, comparten los mismos
lugares de aislamiento primario.
En lo posible, el aislamiento debe ir seguido de la tipificación
serológica mediante la técnica de inmunodifusión
en gel, normalizada, utilizando una preparación
calentada del antígeno. Debe recordarse, al respecto,
que la prueba disponible dista mucho de ser un procedimiento
óptimo de clasificación, a la vista del
gran porcentaje de cepas no tipables descritos por cualquiera
de los autores que han referido resultados de tipificación
en todos los países.
|
|
En algunos lugares se practica un método de fijación
del complemento para la tifipicación, pero
plantea el grave inconveniente de numerosas reacciones
cruzadas entre serotipos, lo que unido a la posibilidad
de que en la misma explotación y aún en
el mismo animal circulen distintos serotipos, representa
un procedimiento muy complicado de usar y extraer conclusiones
prácticas útiles.
La detección directa del
antígeno puede intentarse mediante métodos
inmunohistoquímicos,
por ejemplo un sistema avidina-biotina, como se ha demostrado
en el caso del serotipo 5, en condiciones experimentales,
aunque los resultados dependerán estrictamente
de la calidad de los anticuerpos utilizados (policlonales
o monoclonales). Tiene la ventaja de que pueden aplicarse
a tejidos fijados en formol e incluidos en parafina, pero
no resuelve reacciones falsamente positivas con A.
pleuropneumoniae.
|
| La
detección mediante procedimientos moleculares
posee un gran futuro. A este respecto, nuestro grupo (Rodríguez
Ferri et al.) ha puesto a punto una PCR
(reacción en cadena, de la polimerasa) con primers
diseñados sobre zonas de homología, conservadas,
de las secuencias de los genes tbpB
y tbpA, capaces no solo de detectar
la presencia de H. parasuis entre colonias sospechosas
en cultivo, sino incluso directamente de material patológico
obtenido del cadáver o hisopos de secreción
nasal. |
|
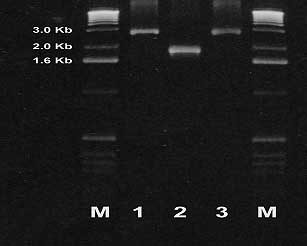
Figura 8a: tbpA-PCR.
A. pleuropneumoniae, H. parasuis y A.suis.
|
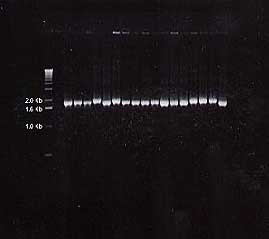
Figura 8b: tbpA-PCR
en H. parasuis, serotipos 1 a 15 (Rodríguez
Ferri et al.)
|
|
El procedimiento
discrimina, en función del tamaño de banda
detectada, la presencia de A. pleuropneumoniae y A. suis.
Otros microorganismos porcinos no patógenos del mismo
género o próximos (A. indolicus, A.
porcinus, A. minor, Haemophilus taxón
C), de la misma familia (P. multocida) o de otras,
resultan claramente diferenciados. El procedimiento puede
completarse mediante un análisis por restricción
con endonucleasas (PCR-RFLP),
utilizando por ejemplo AvaI,
TaqI y RsaI,
que permite diferenciar tipos genéticos en número
importante. |
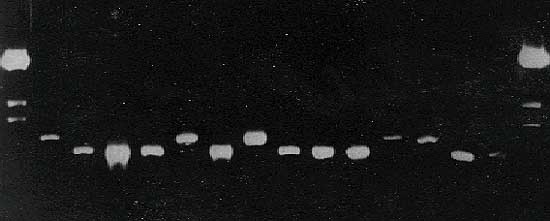
Figura 9.
tbpB-PCR en A. pleuropneumoniae, A.
suis y H. parasuis (Rodríguez Ferri
et al.)
|
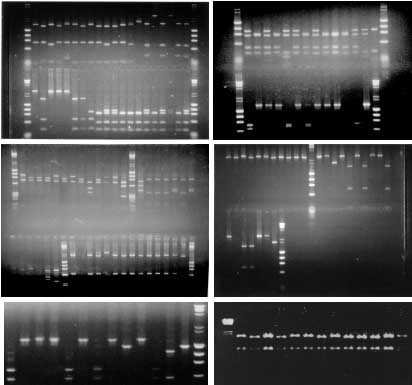
Figura 10.
PCR-RFLP de tbpA de H. parasuis (Rodríguez
Ferri et al.)
|
| La detección
de anticuerpos en el suero de los animales enfermos
no posee demasiado sentido.
Por un lado, no permite diferenciar el serotipo implicado
en la infección y por otro, el porcentaje previsto
de animales portadores de los mismos ha de ser, necesariamente
muy alto y su significación muy escasa, dado el carácter
de comensal habitual en las fosas nasales de animales sanos.
A esto se le suman, además, que en muchas explotaciones
circulan, sin demasiadas consecuencias, cepas de H. parasuis
de virulencia baja o nula, pero que sí inducen respuesta
humoral detectable y que, por otra parte, algunas cepas
de H. parasuis solo son débilmente inmunogénicas,
lo que traduce dificultades para la detección de
la respuesta e incluso tampoco permite disponer de reactivos
de calidad para ello. Las razones anteriores hacen que,
una serología positiva sea absolutamente compatible
con un animal sano, hecho que, por otra parte, es considerado
conveniente desde el punto de vista del control, puesto
que supone una cierta experiencia inmunológica que
previene de procesos agudos que pueden causar desastres
económicos en la explotación. Todavía,
a los inconvenientes anteriores hay que unir la falta de
especificidad que traduce no solo las reacciones cruzadas
entre serotipos, ya comentadas, sino también con
otras especies, como es el caso de A. pleuropneumoniae
y de otras especies de la familia. En la práctica,
se han utilizado diversas opciones serológicas de
diagnóstico, como la reacción de fijación
del complemento, el ELISA
o la inmunofluorescencia. |
| El
ELISA indirecto es, en la actualidad, el procedimiento más
utilizado, con un antígeno obtenido a partir
de un serotipo virulento, con niveles aceptables de sensibilidad
y especificidad, aunque también se presentan reacciones
cruzadas entre serotipos. |
 Imprimir
Imprimir
|