Arias,
M., Romero, L. , Gómez-Villamandos,
J.C. y Sánchez-Vizcaíno,
J.M.
|
Dada
la gran variedad de síntomas y lesiones con las
que puede originar el virus de la PPC, así como
el número de lesiones comunes que puede presentar
con otras enfermedades hemorrágicas del cerdo
(Peste
porcina africana, Pasterelosis
aguda, Salmonelosis,
Mal rojo,
etc.) es esencial llevar
a cabo un diagnóstico de laboratorio. Como en otras
enfermedades infecciosas, este diagnóstico se puede
establecer mediante la detección del virus (de
sus antígenos virales o del ácido nucleico)
y mediante la detección de los anticuerpos.
|
|
DIAGNÓSTICO
DE LABORATORIO
|
| MUESTRAS
A REMITIR AL LABORATORIO |
|
Con
el fin de poder realizar un diagnóstico fiable es
muy importante que la elección de la muestra sea
la adecuada, así como que llegue en buen estado al
laboratorio.
NO PUEDE HABER UN BUEN DIAGNÓSTICO SIN UNA BUENA
MUESTRA. |
En el
caso de la PPC las muestras a enviar serían:
- SANGRE CON ANTICOAGULANTE (EDTA)
- SANGRE SIN ANTICOAGULANTE
- TONSILAS
- GANGLIO MESENTÉRICO Y FARÍNGEO
- BAZO
- ÍLEON DISTAL
- RIÑÓN |
| MATERIAL
NECESARIO PARA LA RECOGIDA DE MUESTRAS: |
Una
ficha de historia clínica. Debe colocarse
en el exterior de la caja en sobre cerrado. Se deben incluir
los siguientes datos:
- Nombre y dirección del propietario.
- Enfermedad sospechosa.
- Pruebas solicitadas.
- Especies animales en la explotación y tiempo
que llevan en la misma. Es muy importante señalar
si ha habido alguna nueva incorporación.
- Fecha de los primeros síntomas.
- Distribución de la enfermedad por la explotación.
- Número de bajas y de animales con sintomatología.
- Tipo de alojamiento y sistema productivo.
- Medicación y vacunaciones administradas en
los últimos días.
- Listado de las muestras remitidas.
|
| |
Una
nevera de transporte de muestras con abundantes
bolsas de refrigerante.
Botes de cierre hermético para la recogida de las
muestras de órganos y tubos de vacío para
la sangre.
Otro bote, también de cierre hermético,
para guardar los botes de las muestras. |
| |
Etiquetas
y rotulador
Si no se usaran tubos al vacío, se llevarán
jeringas de 20 ml desechables con agujas apropiadas a la
edad del cerdo. |
|
Existen diferentes técnicas disponibles
para la detección de virus o de sus antígenos
virales,
|
| -
AISLAMIENTO
VIRAL
- INMUNOFLUORESCENCIA
DIRECTA
|
- INMUNOPEROXIDASA
DIRECTA
-
ELISA
DE CAPTURA DE ANTÍGENO
|
Estas técnicas presentan las siguientes
características y especificaciones:
La técnica de
aislamiento del virus en cultivos celulares está considerada
en la actualidad como la técnica de referencia obligada
en zonas exentas de la enfermedad o como técnica confirmatoria
en caso de duda. Este método
está basado en la capacidad del VPPC de multiplicarse
en determinados cultivos celulares, como la línea
celular de riñón de cerdo conocida como línea
PK 15. Se incuban suspensiones de órganos o leucocitos
durante 24-72 horas sobre una monocapa de esta línea
celular, lo que permitirá que si la muestra es positiva
a VPPC, éste replique en las células.
Dado que el crecimiento del virus no produce efecto citopático,
su presencia debe ponerse de manifiesto mediante un método
de marcado inmunológico. Para ello las células
se fijan a las 24-72 horas, y el antígeno del virus se
detecta mediante un suero anti-VPPC conjugado con peroxidasa
(Inmunoperoxidasa-IPMA) o fluoresceína (Inmunofluorescencia
directa-IFD).
Como conjugado se pueden
emplear anticuerpos policlonales, que no permitirán
diferenciar entre los distintos pestivirus por lo que
será preciso realizar pruebas más específicas,
o bien anticuerpos monoclonales específicos frente
al VPPC. En caso negativo se recultivará hasta
un mínimo de tres veces. Ésta
es una técnica muy sensible, ya que
aunque exista una pequeña cantidad de partículas
virales infecciosas podrá multiplicarse en la
línea celular, y muy
específica gracias a los anticuerpos
monoclonales. Presenta como
único problema que es muy laboriosa y lenta,
pudiendo llevar entre 3 a 10 días.
|
|

|
| INMUNOFLUORESCENCIA
(IFD)
E INMUNOPEROXIDASA DIRECTA (IPD) |
Consisten
en la detección de antígenos virales en
cortes histológicos de órganos sospechosos
mediante la tinción con un conjugado policlonal
(contra todas las proteínas del virus,
no permite la diferenciación entre los pestivirus)
o monoclonal (frente a la proteína E2, permite
la diferenciación entre los diferentes pestivirus)
marcado con isotiocianato de fluoresceína (IFD)
o peroxidasa (IPD).
En cerdos vacunados con la cepa China,
puede detectarse en amígdalas el virus vacunal
mediante IFD hasta como máximo 2 semanas post-vacunación.
Esta característica resulta útil en los
programas de control, ya que en caso de aparecer un resultado
positivo es posible diferenciar virus vacunal del virus
campo mediante el empleo de AcM.
|
| La
ventaja de esta técnica es su gran rapidez (dos a
tres horas); el inconveniente es que no se puede realizar
en un gran número de muestras.
Su utilización está recomendada para diagnóstico
rápido en zonas ya infectadas o con altas sospechas
de estar infectadas, o cuando el número de muestras
no sea muy elevado. El íleon
es el órgano de elección en caso de formas
crónicas de PPC. |
|
|
| El ELISA
de captura para la detección
de los antígenos virales a partir de órganos,
leucocitos sanguíneos y suero de animales sospechosos
se ha utilizado recientemente con aceptable éxito,
dado el nivel de correlación con el aislamiento viral
sobre todo a partir de los 5 a 6 días post infección.
|
|

|
|
La técnica
está basada en un sistema ELISA sandwich en el que
se emplean anticuerpos monoclonales
(AcM) (diferenciales
de pestivirus) para capturar y revelar la captación
de los antígenos virales.
Esta técnica presenta, frente a la anterior, la
capacidad de ser utilizada para el análisis de un
gran número de muestras, pues las diferentes
etapas de la técnica ELISA, incluyendo la lectura,
pueden ser automatizadas. El tiempo
total de realización de este método es de
4 a 18 horas, mayor que en la IFD e IPD, pero mucho menor
que en el aislamiento vírico |
Esta técnica está recomendada en
zonas ya afectadas o con alta probabilidad de ser infectada,
así como cuando el número de muestras sea muy
elevado.
|
DETECCIÓN
DEL ÁCIDO NUCLEICO VIRAL
|
La
técnica de PCR resulta tremendamente práctica,
rápida y eficaz en el diagnóstico de gran número
de enfermedades infecciosas.
| Consiste
en la detección de un pequeño fragmento específico
del ARN del VPPC mediante su amplificación por la
reacción en cadena de la polimerasa. Se ha seleccionado
un fragmento de ARN común a todos los pestivirus
y otro fragmento específico de cada uno de los componentes
de este grupo, lo que permite realizar un diagnóstico
diferencial de gran sensibilidad y especificidad. Además,
es una técnica relativamente rápida (6 horas)
y económica. Sin embargo tiene el inconveniente de
la dificultad en el manejo de un número elevado de
muestras, si bien es posible trabajar con "pooles"
de muestras en lugar de muestras individuales, sin pérdida
significativa de sensibilidad. |
|
|
|
La detección
de anticuerpos es de gran utilidad para comprobar la presencia
o no de zonas libres y no vacunadas, pero no cuando se
sospeche de una infección reciente.
En este caso se deberían emplear no sólo
las técnicas de detección de anticuerpos,
sino también técnicas de detección
viral (antígenos o ácido nucleico).
|
|
Existen
varios métodos para la detección de anticuerpos
de PPC.
Los mas utilizados actualmente son los siguientes:
- VIRUSNEUTRALIZACIÓN
- ELISA
|
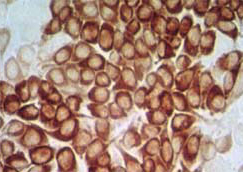
El método de
virusneutralización (VN) consiste en determinar la capacidad
que tiene el suero objeto de estudio de neutralizar el efecto
de un virus sobre una línea celular sensible (PK 15).
Para ello se utilizan diferentes diluciones del suero problema
y se comparan sus resultados frente a un suero control.
|
|
|
Dado
que el VPPC no produce efecto citopático, la posible
acción del virus sobre la célula se visualiza
mediante la incubación con un conjugado de fluoresceína
(NIF) o peroxidasa (NPLA).
La VN es una técnica muy específica y sensible,
pero tiene el inconveniente de su gran laboriosidad, por
lo que no está indicada para un gran número
de muestras. Es la técnica de referencia para la
confirmación de resultados.
|
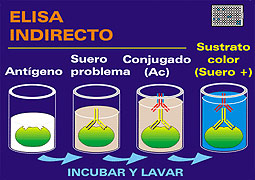
Las
técnicas de enzimoinmunoensayo ELISA,
para la detección de anticuerpos de la PPC que se
utilizan hoy en día, son técnicas rápidas,
sensibles, específicas, de fácil ejecución
y permiten analizar un gran número de muestras a
la vez, por lo que son las utilizadas habitualmente en los
rastreos epidemiológicos, sirviéndonos de
las técnicas de VN para la confirmación de
aquellos sueros que han resultado positivos o dudosos en
la técnica de ELISA. |
|

|
|
Los métodos más utilizados
son los ELISAs de bloqueo, de competición o indirectos,
debiendo detectar anticuerpos frente a todas las cepas
del virus de PPC pero a su vez evitar reacciones cruzadas
con otros Pestivirus. Como antígeno emplean proteínas
virales recombinantes o bien cepas de virus de PPC recomendadas
por los Laboratorios
de Referencia.
|
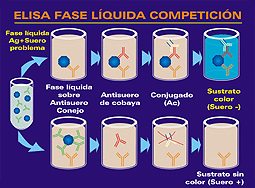
| Se trata de
un ELISA de captura-competición que emplea dos anticuerpos
monoclonales (AcM) específicos
frente a dos epítopos diferentes de la proteína
estructural E2, uno de ellos tapizando las placas (anticuerpo
de captura) y el otro conjugado con peroxidasa (anticuerpo
detector). Como antígeno utiliza una proteína
recombinante obtenida mediante el sistema de baculovirus.
|
|
|
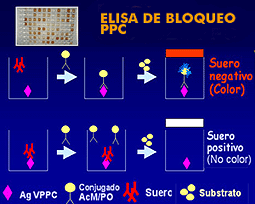
Este tipo de ELISA emplea placas tapizadas con
antígeno de PPC; los anticuerpos presentes en la muestra
bloquearían la posibilidad de unión de un AcM
conjugado con peroxidasa específico frente a la proteína
E2 del VPPC que se añade en un paso posterior. En caso
de que la muestra sea negativa el antígeno permanecerá
libre, por lo que podrá unirse a él el AcM conjugado
con peroxidasa, unión que se detectará mediante
el color producido debido a la reacción de la peroxidasa
con el substrato añadido a continuación.
| Otros ELISAs
de bloqueo no emplean ni AcM ni proteínas recombinantes.
Las placas se encuentran sensibilizadas con antígeno
del virus de la PPC purificado e inactivado (cepa derivada
de la Alfort), y como antisuero utilizan un suero hiperinmune
anti-virus de PPC producido en conejo o cerdo y conjugado
con peroxidasa. En este caso las posibles reacciones cruzadas
con BVD no desaparecen completamente al tratarse de un conjugado
policlonal, si bien la sensibilidad es similar a la de la
VN. |
|
|
| Las placas
de se encuentran tapizadas con un antígeno del VPPC,
y tras la incubación con el suero a testar, la reacción
se pone de manifiesto utilizando como conjugado proteína
A-peroxidasa.
El gran inconveniente de los
tres métodos descritos es que no permiten diferenciar
los anticuerpos de enfermedad de los anticuerpos vacunales,
de las vacunas actualmente comercializadas en la actualidad.
|
|
|
| MÉTODOS
UTILIZADOS PARA EL DIAGNÓSTICO DE LABORATORIO DE
LA PPC |
1. DETECCIÓN DE VIRUS
O ANTÍGENOS VIRALES:
- Aislamiento viral
- Inmunofluorescencia directa
- Inmunoperoxidasa directa
- ELISA de captura
|
| 2. DETECCIÓN DE ÁCIDO
NUCLEICO VIRAL:
|
3. ANTICUERPOS ESPECÍFICOS:
- Virusneutralización (NPLA y NIF)
- ELISA
|
 Imprimir
Imprimir
|